COME FUNZIONA: Caro Visitatore questo sito ha una parte accessibile solo previa iscrizione (FORUM) e accettazione delle regole di uso e una parte informativa accessibile a tutti in cui puoi trovare gli articoli scritti da medici o utenti del nostro forum. NOTA BENE: I COMMENTI AGLI ARTICOLI PUBBLICI SONO VISIBILI A TUTTI.
Se vorrai confrontarti o portare la tua esperienza potrai anche iscriverti al nostro forum, che è riservato e accessibile solo sotto utente e password al fine di osservare le regole di base di privacy dei partecipanti, oppure puoi consultare gli articoli liberamente.
SE TI REGISTRI COME MEMBRO DEL FORUM DI FIBRILLAZIONEATRIALE.IT, POTRAI CONSULTARE ANCHE L'ELENCO DEGLI INDIRIZZI DEI MEDICI CHE GENTILMENTE SI SONO RESI DISPONIBILI A RISPONDERE VIA MAIL.

elena antonioli
Buona sera a tutti già mi conoscete ho dovuto ricreare un account poiché non mi ricordavo Userneme e password. Sapete bene che la mia grande passione è l'elettrocardiografia e su cui ho fondato il gruppo PASSIONE ECG su facebook
ARITMIE: PER SAPERNE DI PIU'
Cari amici ed amiche
Quest'anno a Milano ho organizzatoo un evento importante che interesserà tutti noi che abbiamo problemi di aritmie, infatti Domenica 10 Aprile 2016 alle ore 15 avremo come illustre ospite il Prof. Dott Roberto De Ponti docente di cardiologia dell' Università dell'Insubria e Responsabile del laboratorio di Elettrofisiologia dell'ospedale di Circolo e fondazione Macchi di Varese.
Il medico ci illustrerà le ultime novità in ambito aritmologico e successivamente risponderà alle nostre domande.
L'incontro avverrà presso il CIRCOLO ARCI METISSAGE in via GAETANO DE CASTILLIA 8 angolo via BORSIERI 2 fermata metropolitana LINEA 2 GIOIA A UNA FERMATA DALLA STAZIONE FS DI CENTRALE E DI GARIBALDI.
L'evento sarà preceduto per chi lo desiderasse da un pranzo alle ore 12:30 presso l'OSTERIA BORSIERI di via Borsieri 39 che si trova a circa 300 metri dal circolo sopra nominato al costo di euro 25
Gli interessati possono lasciare la loro adesione all'evento scrivendomi in privato oppure confermando la propria partecipazione in uno dei seguentii gruppi facebook
PASSIONE ECG
CLUB DEI CUORI CAPRICCIOSI
ODDIO N'ALTRA EXTRASISTOLE
SINDROME DI BRUGADA
Vi ringrazio per la cortese collaborazione
Elena Antonioli

QRS LARGO ALL' ECG: SI TRATTA DI TACHICARDIA VENTRICOLARE O TACHICARDIA SOPRAVENTRICOLARE ?
Spesso, può capitare che osservando un tracciato ci si ponga questa domanda: di cosa si tratta? Siamo in presenza di una TACHICARDIA VENTRICOLARE o più semplicemente di una TACHICARDIA SOPRAVENTRICOLARE ?
Prima di tutto rispondiamo alla domanda più semplice: cos'è una tachicardia ? Risposta: si definisce TACHICARDIA quando la frequenza SUPERA I 100 BATTITI AL MINUTO.
In base alla durata si può distinguere se una tachicardia:
SOSTENUTA se dura PIU' di 30 secondi
NON SOSTENUTA se dura meno di 30 secondi
Una tachicardia può presentarsi:
a QRS STRETTI con un tempo di conduzione minore di 120 ms pari a meno di 3 millimetri di larghezza nella carta millimetrata oppure
a QRS LARGHI con un tempo di conduzione superiore o uguale ai 120 ms quindi uguale o superiore ai 3 millimetri di larghezza.
Le CAUSE che possono portare ad un QRS largo sono molteplicI,
Uno dei passi successivi è stabilire se la frequenza è regolare o non regolare.
Si definisce:
REGOLARE quando la distanza tra gli intervalli R-R quindi tra un battito e l'altro rimane COSTANTE, nella maggior parte dei casi se ci si trova il questa situazione la tachicardia sarà di origine VENTRICOLARE.
IRREGOLARE quando la distanza tra gli intervalli R-R VARIA.
Se la frequenza risulta REGOLARE, il QRS LARGO può dipendere da:
TACHICARDIA VENTRICOLARE IN CIRCA 80% DEI CASI
OGNI TACHICARDIA SOPRAVENTRICOLARE CONDOTTA CON BLOCCO DI BRANCA O ABERRANZA in cui i QRS APPAIONO LARGHI E DI MORFOLOGIA ovvero di forma DIVERSA DAL QRS SINUSALE.
OGNI TACHICARDIA SOPRAVENTRICOLARE A CONDUZIONE RITARDATA A CAUSA DI DISFUNZIONE ELETTROLITICA O DOVUTI ALL'ASSUNZIONE DI FARMACI ANTIARITMICI
TACHICARDIA DA WPW IN CUI l'impulso scende per una via ACCESSORIA e risale per la normale via di conduzione
TACHICARDIE CHE VENGONO CONDOTTE DAL PACEMAKER
Se la frequenza risulta IRREGOLARE, il QRS LARGO può dipendere da:
FIBRILLAZIONE ATRIALE CON BLOCCO DI BRANCA O ABERRANZA
OGNI TACHICARDIA SOPRAVENTRICOLARE CONDOTTA CON ABERRANZA PER LA PRESENZA DI UN BLOCCO DI BRANCA
I PRIMI 30 SECONDI DI TACHICARDIA VENTRICOLARE.:
I 5 CRITERI CHE RISOLVONO IL DILEMMA:
PRIMO CRITERIO: LA DURATA DEL QRS
Bisogna analizzare la derivazione precordiale V1, in caso di BLOCCO DI BRANCA SINISTRO se il QRS è maggiore di 160 ms ovvero più di 4 mm di larghezza alla carta millimetrata allora sicuramente si tratta di TACHICARDIA VENTRICOLARE, se inferiore bisognerà valutare la diagnosi,
In caso di BLOCCO DI BRANCA DESTRA analizzando sempre la derivazione precordiale V1 se il QRS è maggiore di 140 ms allora è indice di TACHICARDIA VENTRICOLARE mentre se è inferiore bisogna valutare la diagnosi
SECONDO CRITERIO: LA DISSOCIAZOPNE ATRIO VENTRICOLARE:
Questa condizione è indice sicuramente di TACHICARDIA VENTRICOLARE.
All'elettrocardiogramma appaiono più QRS che onde P poichè i ventricoli si attivano in numero maggiore rispetto agli atri
VARIETA' DI AMPIEZZA DEI QRS in cui uno o più complessi ventricolari appaiono diversi dagli altri
BATTITI DI CATTURA E DI FUSIONE in cui i QRS appaiono meno larghi ed è dovuto al fatto che l'impulso èroveniente dal nodo seno atriale attiva il nodo atrio ventricolare e parzialmente o interamente i ventricoli.
Se i ventricoli vengono attivati INTERAMENTE saranno presenti battiti di CATTURA
Se i ventricoli vengono attivati PARZIALMENTE saranno preenti battiti di FUSIONE..
TERZO CRITERIO: ASSE DEL QRS
Un asse elettrico ventricolare e quindi del QRS COMPRESO TRA -90° E I - 180° DEPONE ASSOLUTAMENTE PER UNA TACHICARDIA VENTRICOLARE
Così come una variazione dell'asse del QRS tra l'episodio aritmico e il ritmo sinusale è maggiore o uguale a 40° allora la diagnosi è suggestiva di TACHICARDIA VENTRICOLARE
QUARTO CRITERIO. CONCORDANZA DEL QRS
Si osservano tutte le DERIVAZIONI PRECORDIALI quindi da V1 A V6 se esse appaiono tutte con
QRS NEGATIVO la diagnosi è sempre di TACHICARDIA VENTRICOLARE
QRS POSITIVO la diagnosi è quasi sempre di TACHICARDIA VENTRICOLARE
QUINTO CRITERIO: COMPLESSI IN V1 E V6 E BLOCCO DI BRANCA DESTRA
Se guardiamo la derivazione precordiale V1 e ci accorgiamo che abbiamo un QRS A MORFOLOGIA rSr'' si tratta di una TACHICARDIA SOPRAVENTRICOLARE condotta con ABERRANZA
Se invece sempre in V1 abbiamo una R grande o una Rsr allora ci sarà diagnosi di TACHICARDUA VENTRICOLARE.
Se guardiamo la derivazione precordiale V6 e troviamo un complesso ventricolare RS allora si tratta di TACHICARDIA SOPRAVENTRICOLARE.
Se invece troviamo una R allora la diagnosi è di TACHICARDIA VENTRICOLARE.
Il quinto criterio prende in considerazione anche il QRS IN V1 E V6 E BLOCCO DI BRANCA SINISTRO
Se l'onda R in V1 è maggiore di 30 ms la diagnosi è di TACHICARDIA VENTRICOLARE
Se in V6 NON VI è PRESENZA DI ONDA q akkora la diagnosi depone per una TACHICARDIA SOPRAVENTRICOLARE CONDOTTA CON ABERRANZA
TRATTAMENTO CHIRURGICO E TORACOSCOPICO IBRIDO DELLA FIBRILLAZIONE ATRIALE
Nel mese di Marzo si è svolto a Varese presso l'ospedale di Circolo e fondazione Macchi un congresso dal titolo TRATTAMENTO CHIRURGICO E TORACOSCOPICO IBRIDO DELLA FIBRILLAZIONE ATRIALE nel quale erano presenti il Prof. Cesare Beghi direttore della cardiochirurgia dell'ospedale di Circolo, il Prof Roberto De Ponti Professore associato di Cardiologia università degli studi dell'Insubria, il Prof. Antonio Curnis responsanile di aritmologia dell'ospedale civile di Brescia e il Prof. Muneretto responsabile della cardiochirurgia di Brescia.
All'inizio del congresso oltre alla classica suddivisione dei vari tipi di fibrillazione atriale come sappiamo già tutti in PAROSSISTICA, PERSISTENTE E PERMANENTE si è data importanza al fatto di come la fibrillazione atriale non sia più solo una patologia prevalentemente presente in una popolazione anziana, ma si sta sviluppando sempre più frequentemente anche nei quarantenni che cresce esponenzialmente con l'avanzare dell'età poichè il cuore invecchia e conseguentemente si ha un rimdellamento atriale per decrescere verso i novantanni
Si è visto come nella FIBRILLAZIONE ATRIALE PAROSSISTICA ovvero di breve durata e che tende al ripristino del ritmo sinusale spontaneamente, le responsabili dell'insorgenza di questa aritmia siano le VENE POLMONARI sia SUPERIORE DESTRA CHE SUPERIORE SINISTRA raramente sono quelle inferiori mentre nella FIBRILLAZIONE PERSISTENTE E PERMANENTE ciò che innesca tale aritmia sia il SUBSTRATO ATRIALE che porta ad un rimodellamento e ingrandimento degli atri.
La cardioversione farmacologica prima e la cardioversione elettrica sono le teraie di prima scelta nel ripristino del ritmo sinusale mentre i farmaci antiaritmici, AMIODARONE come farmaco di prima scelta viene utilizzato come terapia nel mantenere il ritmo sinusale.
Se nonostante i farmaci antiaritmici vi fossero delle recidive di fibrillazione atriale ecco che allora l'ablazione transcatetere sembra essere l'unica scelta da provare in prima istanza. DOMANDA::vi siete mai chiesti perchè dopo alcuni giorni dopo l'ablazione transcatetere endocavitaria possono manifestarsi recidive di fibrillazione atriale nonostante che durante terapia ablativa non si siano sviluppati potenziali da poter far pensare all'innesco di fibrillazione atriale ? Le risposte possono essere due: la formazione di edema nella zona ablata oppure il fatto che nel substrato esterno dell'atrio ovvero il PERICARDIO possono essere presenti deI FOCUS ECTOPICI che sviluppano potenziali tali da poter innescare fibrillazione atriale.
Quindi allora che si fa? In entrambi i casi ci sono le risposte: Nel primo caso se si sospetta la presenza di edema si lascia che esso venga riassorbito e se poi si manifesta ancora recidive di fibrillazione atriale si procede ancora all'ablazione andando a bloccare i potenziali attivi. Nel caso in cui non ci fosse formazione di edema ma le recidive di fibrillazione atriale parossistica fossero numerose il sospetto che ci siano foci esterne in grado di attivare l'innesco di fibrillazione atriale nel substrato è un'ipotesi ben documentato.
Da qui l'idea di una collaborazione tra ELETRROFISIOLOGO ( il professor CURNIS ) E CARDIOCHIRURGO (il professor MUNERETTO ) agli spedali di Brescia, Insieme hanno sviluppato un trattamento chirurgico e toracoscopico ibrido della FA. Vi domanderete, perchè IBRIDO ? Risposta: Perchè unisce nello stesso intervento sia un'ABLAZIONE ENDOCAVITARIA effettuata dall' ELETTROFISIOLOGO sia un'ABLAZIONE PERICARDICA effettuata dal CARDIOCHIRURGO IN TORACOSCOPIA.
Questa opzione per il trattamento della fibrillazione atriale può essere effettuato sia per la fibrillazione atriale parossistica in cui le recidive siano davvero numerose sia per le fibrillazioni atriali persistenti e permanenti quando nonostante la terza o quarta ablazione tradizionale sia fallita e può essere una valida alternativa alla MAZE III E IV.
Per la fibrillazione Triale PAROSSISTICA Si effettuano solo tre buchi nel torace del paziente, nel buco centrale si introduce una telecamera per la scopia nel buco superiore e inferiore due introduttori bipolari quindi uno con polo positivo e l'altro con polo negativo per catetere che vanno uno in vena cava superiore e l'altro in vena cava inferiore, si uniscono a formare un tutt'uno e una volta introdotti dei cateteri speciali che raggiungono la zona desiderata da ablare, si crea come un risucchio della parete da ablare che rimane come INTRAPPOLATA come se fosse in una scatola, si emette radiofrequenza a circa 70° e in tal modo facendo scorrere i cateteri si ottiene il completo isolamento sia interno che esterno delle vene polmonari da questo il nome di BOX LESION.
Questa tecnica ablativa può essere utilizzata come abbiamo detto precedentemente ANCHE per la fibrillazione atriale PERSISTENTE E PERMANENTE in entrambi i casi dato che il responsabile maggiore è l'ingrandimento atriale l'ablazione ibrida verrà estesa sia alle vene polmonari sia al substrato atriale.
C'è da dire inoltre che a volte gli inconvenienti possono capitare e anche in questo caso l'ablazione potrebbe non riuscire, in rari casi il grasso a livello posteriore del cuore può rappresentare un problema soprattutto in pazienti obesi poichè il grasso non permette il completo isolamento e quindi l'ablazione può fallire.
L'unica complicazione che è stata segnalata è un'iniziale PERICARDITE poichè quando si va ad ablare il substrato atriale si crea un'infiammazione del pericardio che va curata con antiinfiammatori.
I NUOVI ANTICOAGULANTI ORALI
I NUOVI ANTICOAGULANTI ORALI ( NAO )
I nuovi anticoagulanti orali (NAO), inibitori diretti della trombina (dabigatran) e inibitori diretti del fattore Xa (rivaroxaban, apixaban), negli studi di fase III hanno dimostrato almeno una non inferiorità nei confronti del warfarin nella riduzione del rischio tromboembolico della fibrillazione atriale (FA). Inoltre hanno comportato una riduzione dei sanguinamenti fatali, in particolare delle emorragie intracraniche. I NAO presentano il vantaggio di essere somministrabili in dosi fisse giornaliere e di non richiedere il monitoraggio periodico dell’ international normalized ratio (INR). Negli anziani pertanto i NAO potrebbero diventare in futuro il trattamento anticoagulante di scelta.
Numerosi trial clinici randomizzati e successive metanalisi hanno dimostrato che la terapia anticoagulante orale (TAO) con warfarin è altamente efficace nella prevenzione primaria e secondaria dell’ictus nei pazienti affetti da FA1,2. Con il warfarin si ottiene una riduzione del rischio di ictus del 64%3, controbilanciata però da un aumento delle emorragie maggiori, pari all’1.2% per anno nei trial, ma molto maggiore nei registri. Il timore delle emorragie costituisce la remora principale per l’utilizzo della TAO, soprattutto nei pazienti anziani, per i quali esiste sicuramente un aumentato rischio emorragico connesso alla TAO4. Questo spiega l’apparente paradosso che i pazienti ultra75enni, esposti ad un maggior rischio di ictus in presenza di FA, sono proprio quelli meno trattati. Complessivamente, soltanto la metà dei pazienti affetti da FA sono effettivamente trattati con warfarin e nei soggetti anziani il sottoutilizzo è ancora maggiore5.
Sono stati recentemente pubblicati i risultati dello studio multicentrico osservazionale ATA-AF6, in cui sono stati valutati, nel periodo compreso tra maggio e luglio 2010, i pazienti con FA afferiti a 164 cardiologie e 196 reparti di medicina interna, rappresentativi in termini di distribuzione geografica della realtà ospedaliera italiana. I pazienti arruolati avevano un’età mediana di 77 anni e nel 47% dei casi erano femmine. Per la prevenzione del rischio tromboembolico la TAO è stata prescritta soltanto nel 58.8% dei casi, ed in assenza di correlazione con il CHA 2DS2-VASc score. La prescrizione della TAO è risultata influenzata maggiormente dall’età (66.2% nei pazienti di età ≤75 anni vs 53.1% nei pazienti di età >75 anni, p<0.0001) (Figura 1), dal tipo di FA (64.3% nei casi di FA permanente, 69.6% nei casi di FA persistente e soltanto 37.4% nei pazienti con FA parossistica, p<0.0001) e dalla strategia terapeutica adottata (63.2% in caso di strategia di controllo della frequenza vs 59.7% in caso di strategia di controllo del ritmo, p<0.0001).
In letteratura, peraltro, è stato dimostrato che nei pazienti affetti da FA il beneficio clinico netto che si ottiene con la TAO aumenta con l’età7. Nel 2007 lo studio BAFTA ha dato ulteriore supporto all’efficacia e alla sicurezza del warfarin nel trattamento di 973 pazienti con FA di età ≥75 anni (età media 81.5 ± 4.2 anni)8. L’incidenza annua di eventi tromboembolici è risultata dell’1.8% nei pazienti trattati con warfarin e del 3.8% in quelli trattati con aspirina, con un rischio relativo (RR) di 0.48 (p=0.003), in assenza di un significativo aumento del rischio emorragico. L’incidenza annua di emorragie maggiori, infatti, non è stata diversa tra i due trattamenti, rispettivamente 1.9% per il warfarin e 2.0% per l’aspirina. In uno studio prospettico italiano pubblicato nel 2011 la sicurezza del warfarin è stata inoltre dimostrata in un’ampia casistica (4093 pazienti) di ultra80enni in TAO per FA o per tromboembolia venosa seguiti nei Centri di Sorveglianza della TAO 9. È stato riportato un rischio annuo di emorragie maggiori dell’1.87% e di emorragie fatali dello 0.27%. Pertanto, l’età avanzata di per sé non deve essere considerata una controindicazione alla TAO negli anziani con FA. Recentemente, uno studio nord-americano ha documentato che l’impiego di warfarin in pazienti con FA di età >70 anni si associa ad una riduzione di mortalità (hazard ratio 0.58, p<0.001), in assenza di sanguinamenti maggiori (hazard ratio 0.73, p=0.229) 10. Se la TAO viene accuratamente condotta, con l’esclusione dei soggetti ad elevato rischio emorragico, anche negli ultra75enni con FA i benefici risultano ampiamente superiori ai rischi.
In letteratura, è peraltro riportata in molti pazienti una inadeguata qualità dell’anticoagulazione. Anche attuando frequenti monitoraggi ed aggiustamenti della dose, i pazienti in trattamento con warfarin risultano per oltre un terzo del tempo al di fuori del target terapeutico (tempo nel range terapeutico, TTR)11. Una metanalisi di studi pubblicati tra il 2005 ed il 2008 ha evidenziato che complessivamente i pazienti con FA sono solo per il 55% del loro tempo con INR all’interno del TTR12. Dati italiani recentemente pubblicati di registri amministrativi dimostrano che nel nostro Paese il TTR medio dei pazienti warfarin-naïve è 47.9%, mentre quello dei pazienti warfarin-experienced è 56.3% (Tabella 1). Entrambi questi valori rimangono al di sotto del valore considerato soddisfacente (60%)13.
In questo scenario si colloca l’introduzione dei NAO, studiati e sviluppati a seguito dei noti limiti della TAO con warfarin (lento inizio d’azione, risposta non prevedibile, stretta finestra terapeutica, necessità di monitoraggio routinario dei fattori della coagulazione e numerose interazioni farmacologiche ed alimentari), e del conseguente sottoutilizzo nei pazienti affetti da FA.
I NUOVI ANTICOAGULANTI ORALI
I NAO sono rappresentati dagli inibitori diretti orali della trombina (dabigatran) e del fattore Xa (rivaroxaban e apixaban), la cui efficacia e sicurezza sono state testate dapprima nella prevenzione della trombosi venosa profonda e dell’embolia polmonare in pazienti sottoposti a chirurgia elettiva dell’anca o del ginocchio.
Dal 2009 ad oggi sono stati pubblicati tre studi di fase III nei quali i NAO sono stati confrontati con il warfarin nella prevenzione del rischio tromboembolico associato alla FA (Figura 2).
Dabigatran
Il dabigatran è un inibitore diretto orale reversibile della trombina, caratterizzato da una biodisponibilità del 6.5%, un’emivita plasmatica di 12-17h ed eliminazione renale per l’80%. Nello studio RE-LY14-16 il dabigatran è risultato non inferiore al warfarin a dosi aggiustate (INR 2.0-3.0) al dosaggio di 110 mg bid (RR 0.91, p<0.001) e superiore al warfarin a dosi aggiustate al dosaggio di 150 mg bid (RR 0.66, p<0.001) nella riduzione del rischio tromboembolico di 18 113 pazienti affetti da FA non valvolare. L’impiego di dabigatran 150 mg si è inoltre associato ad una riduzione statisticamente significativa dell’incidenza di ictus ischemico. Per quanto riguarda l’endpoint di sicurezza l’incidenza di sanguinamenti maggiori rispetto al warfarin è risultata inferiore con il dosaggio 110 mg bid (RR 0.80, p=0.003) e sovrapponibile con il dosaggio 150 mg bid. L’incidenza di sanguinamenti cerebrali correlata all’utilizzo di dabigatran è risultata significativamente inferiore (riduzione del 60% circa) rispetto a quella in corso di warfarin, indipendentemente dal dosaggio del farmaco e dall’età dei pazienti. È da sottolineare il fatto che all’interno dello studio RE-LY più di un terzo dei pazienti (in totale, 7258) aveva un’età >75 anni. In tale sottogruppo il dabigatran al dosaggio di 150 mg bid ha comportato un rischio emorragico superiore a quello del warfarin (5.10 vs 4.37%/anno), mentre al dosaggio di 110 mg bid il rischio di sanguinamenti è risultato sovrapponibile a quello del warfarin (4.43 vs 4.37%/anno, p<0.001) (Figura 3) 17. Gli stessi dati sono stati confermati in un’analisi post-hoc sui pazienti “very elderly” (ovvero ultra80enni; in totale, 3016) dello studio RE-LY, rispettivamente ≥80 anni (17%), ≥85 anni (4%) e ≥90 anni (0.4%)18. Il rischio annuo di emorragie maggiori associato all’impiego di dabigatran 110 mg bid è risultato 5.25%, sovrapponibile a quello del warfarin (4.7%), mentre quello associato all’uso di dabigatran 150 mg bid è risultato superiore a quello del warfarin (6.24%). Pertanto, negli anziani è raccomandato l’utilizzo della posologia di 110 mg bid. Un dato assolutamente importante in proposito è la sovrapponibilità dei risultati del confronto dabigatran-warfarin nei pazienti warfarin-naïve ed in quelli warfarin-experienced, rappresentati in percentuali simili all’interno del braccio dei pazienti randomizzati al warfarin19. In una successiva sottoanalisi dello studio RE-LY, il dabigatran è inoltre risultato almeno non inferiore al warfarin anche nel sottogruppo di pazienti con pregresso ictus o attacco ischemico transitorio (TIA), popolazione nella quale risulta particolarmente rilevante la riduzione dell’ictus emorragico in confronto al warfarin20.Rivaroxaban
Il rivaroxaban è un inibitore diretto orale del fattore Xa con elevata biodisponibilità (80%) ed emivita plasmatica di 7-11h, che presenta il vantaggio, rispetto agli altri NAO, della monosomministrazione giornaliera. È metabolizzato per due terzi nel fegato e per un terzo è eliminato per via renale.
L’efficacia del rivaroxaban nella FA è stata valutata nello studio ROCKET AF21 nel quale 14 171 pazienti con FA sono stati randomizzati a ricevere rivaroxaban 20 mg/die, ridotto a 15 mg/die nei pazienti con insufficienza renale moderata (clearance della creatinina 30-49 ml/min), oppure warfarin (INR 2.0-3.0). I pazienti con FA inclusi nello studio ROCKET AF erano caratterizzati da un profilo di rischio tromboembolico maggiore rispetto a quelli dello studio RE-LY (CHADS2 score ≥3 nell’87 vs 32% nel RE-LY, e pregresso ictus o TIA nel 55 vs 20% nel RE-LY). Il rivaroxaban è risultato non inferiore al warfarin, con un tasso annuale di ictus ed embolia sistemica del 2.12 vs 2.42% (p<0.001) riportato con il warfarin. Gli eventi emorragici correlati all’impiego del NAO sono risultati numericamente sovrapponibili a quelli del warfarin, ma con una significativa riduzione dei sanguinamenti fatali (0.2 vs 0.5%/anno, p=0.003) e cerebrali (0.5 vs 0.7%/anno, p=0.02). Il rivaroxaban inoltre, in considerazione della ridotta quota di eliminazione per via renale, si è dimostrato particolarmente sicuro nei pazienti affetti da insufficienza renale di grado moderato ( clearance della creatinina 30-49 ml/min), che rappresenta la comorbosità più frequente nel soggetto anziano22.
Apixaban
L’apixaban è un inibitore diretto orale del fattore Xa a rapido assorbimento, con biodisponibilità del 66%, escreto soltanto per il 25% per via renale.
È stato dapprima testato vs aspirina nello studio AVERROES (studio di superiorità) in pazienti affetti da FA non eleggibili per la TAO. Lo studio è stato prematuramente interrotto per l’evidenza di superiorità, peraltro attesa, di apixaban al dosaggio di 5 mg bid nella riduzione degli eventi tromboembolici rispetto all’aspirina a vari dosaggi (81-324 mg/die), con un tasso di emorragie maggiori ed in particolare intracraniche sovrapponibile per i due tipi di trattamento23.
In seguito, nell’ARISTOTLE l’apixaban è stato confrontato al dosaggio di 5 mg bid con il warfarin a dosi aggiustate (INR 2.0-3.0) in pazienti affetti da FA e con un fattore di rischio per l’ictus ischemico24. Nel trial, il NAO veniva testato ad un dosaggio ridotto (2.5 mg bid) nei pazienti ad elevato rischio emorragico (ovvero in presenza di due o tre dei seguenti criteri: età ≥80 anni, peso ≤60 kg, creatinina ≥1.5 mg). Apixaban è risultato superiore al warfarin nella prevenzione di ictus ed embolie sistemiche (1.27 vs 1.60%/anno, p=0.01). Tale superiorità è stata documentata anche per l’endpoint di sicurezza, con una riduzione significativa delle emorragie maggiori (2.13 vs 3.09%/anno, p<0.001) e delle emorragie cerebrali (0.33 vs 0.80%/anno, p<0.001). L’efficacia e la sicurezza dell’apixaban sono risultate ancora più significative nel sottogruppo di pazienti affetti da FA con precedente ictus o TIA, come dimostra una sottoanalisi dello studio ARISTOTLE, in cui la riduzione annua del rischio di eventi tromboembolici rispetto al warfarin è risultata essere 0.77% (vs 0.22% nei soggetti affetti da FA senza ictus/TIA anamnestico) 25.
Edoxaban
Il panorama dei NAO si arricchirà ulteriormente, nel corso dei prossimi anni, di una nuova molecola, l’edoxaban, un inibitore diretto del fattore Xa con elevata biodisponibilità (62%), escreto per il 50% per via renale che coniuga il vantaggio della monosomministrazione (caratteristica propria anche a rivaroxaban) con la possibilità dell’aggiustamento del dosaggio (caratteristica propria anche a dabigatran).
Entro il 2013 sono attesi i risultati dello studio di fase III ENGAGE AF-TIMI 4826, nel quale circa 20 000 pazienti con FA ad elevato rischio tromboembolico (CHADS2 score ≥2) sono stati randomizzati a ricevere edoxaban 30 mg/die o 60 mg/die, confrontato con il warfarin a dosi aggiustate (INR 2.0-3.0) con l’obiettivo di dimostrarne la non inferiorità.
Nonostante i risultati siano ancora attesi e, quindi, non sia possibile al momento un confronto di efficacia e sicurezza rispetto agli altri NAO, per il duplice, contemporaneo vantaggio della monosomministrazione e della possibilità di aggiustamento posologico, potrebbe rappresentare un’opzione terapeutica particolarmente indicata negli anziani, nei quali queste caratteristiche potrebbero garantire maggiore aderenza e migliore personalizzazione del trattamento anticoagulante in base alle comorbosità presenti.
VANTAGGI DEI NUOVI ANTICOAGULANTI ORALI
In aggiunta alla dimostrazione di ampia efficacia e sicurezza, i NAO si distinguono dal “vecchio” warfarin per la non necessità di monitoraggio dei livelli di scoagulazione e per la possibilità di essere assunti in dosi giornaliere fisse. Questi due aspetti risultano particolarmente rilevanti nel soggetto anziano, in cui frequentemente la TAO non viene prescritta non per reali controindicazioni cliniche, bensì per difficoltà logistiche nel monitoraggio periodico dell’INR o per possibilità di scarsa compliance alla terapia, come riportato nel trial AVERROES23. Con l’impiego dei NAO, pertanto, verrebbero meno le più frequenti motivazioni di non utilizzo del warfarin e si andrebbe a colmare almeno in parte il sottotrattamento dei pazienti affetti da FA27.
Nei soggetti anziani, inoltre, i NAO potrebbero rappresentare l’anticoagulante di scelta in considerazione della significativa riduzione del rischio emorragico che comportano, ed in particolare dei sanguinamenti cerebrali e fatali. Recentemente, inoltre, è stato reso noto mediante un comunicato della Food and Drug Administration, che nel mondo reale i sanguinamenti secondari all’impiego di dabigatran negli anziani sono risultati meno frequenti di quelli osservati nel RE-LY28.
I pazienti anziani sono esposti infatti ad una maggior incidenza di eventi emorragici, dipendente dall’età e dalle comorbosità. A riguardo, in un recente studio di popolazione canadese è stata documentata un’incidenza di eventi emorragici in corso di trattamento con warfarin nettamente superiore a quella riportata nei trial clinici randomizzati. In una casistica di circa 125 000 soggetti ultra66enni affetti da FA, durante un follow-up di 10 anni, l’incidenza annua di emorragie è risultata 3.8% (vs 1-3% riportato nei trial). Come già noto in letteratura, è stato confermato che il maggior numero di eventi emorragici si è verificato nei primi 30 giorni dall’inizio della TAO (incidenza annua per persona pari all’11.8%) 29.
Negli anziani, comunemente in polifarmacoterapia per le comorbosità, i NAO presentano anche il vantaggio di avere poche interferenze farmacologiche con farmaci peraltro di non frequente impiego. Occorre infatti cautela nell’impiego dei NAO in associazione a potenti induttori o inibitori della glicoproteina P, quali claritromicina, verapamil, ketoconazolo e ciclosporina. Le concentrazioni plasmatiche di rivaroxaban ed apixaban inoltre possono essere influenzate dai forti induttori o inibitori del citocromo P450 isoforma CYP3A4 29.
Infine, i NAO risultano farmaci ampiamente maneggevoli data la breve emivita, con inizio e termine d’azione rapidi, che ne consentono la sospensione in caso di intervento chirurgico senza necessità di embricazione con eparina a basso peso molecolare.
POTENZIALI CRITICITÀ DEI NUOVI ANTICOAGULANTI ORALI
Attualmente, nonostante il grande entusiasmo per l’introduzione nella pratica clinica dei NAO, rimangono da definire:
a) un sistema di monitoraggio laboratoristico in caso di eventi emorragici o trombotici;
b) la gestione dei sanguinamenti, data la mancanza di un antidoto per questi nuovi farmaci;
c) un sistema di sorveglianza dei pazienti per valutare l’aderenza alla terapia.
Dopo la somministrazione dei NAO, diversi test coagulativi risultano alterati, con un prolungamento del tempo di protrombina, del tempo di tromboplastina parziale attivato (aPTT), del tempo di trombina e del tempo di ecarina30. Questi ultimi due parametri sono i più affidabili per la determinazione quantitativa del livello di anticoagulazione ottenuto con dabigatran. Nei casi in cui i test quantitativi non siano disponibili, per dabigatran può essere utilizzato l’aPTT. Se quest’ultimo risulta >80 s, il rischio emorragico è elevato. L’intensità di scoagulazione ottenuta con rivaroxaban ed apixaban invece sembra correlare in maniera soddisfacente con le misurazioni del tempo di protrombina.
Per la gestione degli eventi emorragici, occorre fare delle distinzioni in base all’entità del sanguinamento. Se è lieve, disponendo di farmaci con breve emivita, è sufficiente procrastinare l’assunzione della dose successiva o sospendere temporaneamente il trattamento per arrestare il sanguinamento. In caso di emorragia di grado moderato/severo, deve essere mantenuta la volemia con infusione di liquidi e trasfusioni di plasma fresco congelato. Se il paziente è in terapia con dabigatran, possono essere utili la somministrazione di carbone attivato, per ridurne l’assorbimento gastrointestinale soprattutto se l’ultima dose è stata assunta entro le 2h precedenti, e l’emodialisi per rimuovere il farmaco dal circolo, data la consistente quota di escrezione per via renale (80%). In caso di eventi emorragici che potrebbero risultare fatali, per antagonizzare l’effetto anticoagulante viene consigliata la somministrazione di concentrati di complessi protrombinici (attivati e non attivati) e di fattore VII attivato ricombinante 31.
Infine, la criticità verosimilmente più rilevante per l’impiego dei NAO è rappresentata dall’identificazione di un sistema di sorveglianza clinica dei pazienti. La mancanza della necessità di un monitoraggio periodico dei parametri emocoagulativi può comportare il rischio di una sorveglianza non adeguata del paziente anticoagulato, che potrebbe non essere consapevole dell’importanza e dei rischi della nuova terapia. Pertanto, si rendono indispensabili:
a) un colloquio informativo con il paziente al momento della prima prescrizione dei NAO;
b) controlli clinici periodici (almeno ogni 3 mesi) per valutare la compliance, per registrare eventuali eventi emorragici anche minori non segnalati, e per verificare variazioni delle terapie concomitanti e modifiche significative nel tempo del rischio emorragico (comparsa di deficit cognitivi, insorgenza di nuove comorbosità, ecc.);
c) controlli ravvicinati della funzionalità renale. Negli anziani sono infatti particolarmente frequenti variazioni della creatinina per concomitante assunzione di farmaci interferenti e per tendenza alla disidratazione26.
Infine, il costo rappresenta un’altra potenziale criticità per l’impiego dei NAO nella comune pratica clinica, pur considerando il risparmio del monitoraggio laboratoristico periodico dell’INR necessario per il warfarin. Numerose analisi di costo-efficacia sono però risultate favorevoli all’utilizzo dei NAO, in considerazione della riduzione dei costi, che si ottiene anche attraverso la riduzione degli eventi tromboembolici ed emorragici32,33. Un’analisi di budget impact, recentemente pubblicata, che ha preso in considerazione in diversi scenari clinici il costo del dabigatran, il costo del monitoraggio dell’INR e quello degli eventi tromboembolici, ha confermato che nel nostro Paese l’impiego di dabigatran è economicamente sostenibile, consentendo perfino un risparmio per il Sistema Sanitario Nazionale nella gestione dei pazienti affetti da FA a partire dal secondo anno di trattamento rispetto all’utilizzo del warfarin 34.
PAZIENTI ELEGGIBILI AI NUOVI ANTICOAGULANTI ORALI
Nei pazienti con FA di nuovo riscontro ed indicazione alla TAO (warfarin-naïve), i NAO si collocano come l’anticoagulante di scelta anche nella popolazione degli anziani e molto anziani35. Indicazioni prioritarie per i NAO sono rappresentate dai pazienti con difficoltà logistiche nell’effettuare il monitoraggio laboratoristico periodico o con pregresso ictus ischemico o emorragia intracranica.
Diverso è lo scenario dei pazienti con FA già in TAO (warfarin-experienced). Se il controllo della TAO è affidabile con un TTR soddisfacente (≥60%) può essere ragionevole non attuare uno switch immediato ai NAO, tranne che per espressa volontà del paziente.
Esiste tuttavia un significativo numero di pazienti, soprattutto anziani, nei quali la qualità della TAO non è soddisfacente (TTR <60%) per compliance non ottimale o per difficoltà logistiche nella gestione della terapia. Inoltre, non è raro il verificarsi di eventi tromboembolici o emorragici correlati ad ampie fluttuazioni dell’INR o anche in corso di TAO con INR in range terapeutico. In questi pazienti, che complessivamente costituiscono circa un terzo dei pazienti in TAO, è ragionevole lo switch dal warfarin ai NAO. Infine, la prescrizione dei NAO sarà sicuramente raccomandata in quell’ampia categoria di pazienti affetti da FA attualmente esclusi dalla TAO per un elevato rischio emorragico, oppure trattati con aspirina nell’erronea convinzione che la terapia antiaggregante comporti un rischio emorragico inferiore a quello della TAO36.
CONCLUSIONI
I NAO rappresentano una delle più importanti innovazioni terapeutiche dell’ultimo decennio. Complessivamente, come effetto di classe hanno dimostrato un’efficacia almeno non inferiore rispetto al warfarin nella riduzione degli eventi tromboembolici nei pazienti affetti da FA non valvolare e, allo stesso tempo, sono risultati sicuri, con una riduzione statisticamente significativa delle emorragie fatali, in particolare di quelle intracraniche (Figura 4)14,15,21,24. Il loro impiego, inoltre, si associa ad un trend di riduzione della mortalità. Pertanto negli anziani, che presentano un elevato rischio tromboembolico ed emorragico, rappresentano il trattamento anticoagulante di scelta, in considerazione anche delle difficoltà che l’utilizzo del warfarin presenta in questa categoria di pazienti.
RIASSUNTO
La terapia anticoagulante orale (TAO) con inibitori della sintesi di fattori della coagulazione K-dipendenti riduce significativamente il rischio tromboembolico nei pazienti con fibrillazione atriale (FA), ma comporta un aumento del rischio emorragico. Nei pazienti anziani è stato dimostrato che il beneficio clinico netto della TAO aumenta con l’età, nonostante un rischio emorragico maggiore. Pur con queste evidenze, nella pratica clinica si assiste ad un sottoutilizzo della TAO. Inoltre, il tempo trascorso all’interno del range terapeutico non risulta soddisfacente, con conseguente aumento del rischio tromboembolico ed emorragico. Il sottoutilizzo e la qualità subottimale del trattamento anticoagulante risultano più frequenti nei pazienti anziani. In questi, potrebbe essere particolarmente vantaggioso l’impiego dei nuovi anticoagulanti orali, che non richiedono monitoraggio sistematico del grado di anticoagulazione e, a parità – o in alcuni studi con superiorità – dell’effetto protettivo contro gli eventi cardioembolici, sembrano garantire anche un minor rischio di eventi emorragici maggiori.
Parole chiave. Anticoagulanti orali; Anziani; Fibrillazione atriale; Rischio emorragico; Rischio tromboembolico.
ARTICOLO TRATTO DAL GIORNALE ITALIANO DI CARDIOLOGIA
LE EXTRASISTOLE VENTRICOLARI
LE EXTRASISTOLE VENTRICOLARI
Le extrasistole ventricolari riconosciute anche come BATTITI ECTOPICI VENTRICOLARI (BEV) o BATTITI PREMATURI VENTRICOLARI essendo ECTOPICI non nascono nel NIDO SENO ATRIALE ma in questo caso al di sotto della BIFORCAZIONE DEL FASCIO DI HIS nel SETTO INTERVENTRICOLARE situato tra i due ventricoli
Le extrasistole ventricolari possono presentarsi in modo SPORADICO. IRREGOLARE ma anche in forma CONTINUATIVA oppure REGOLARE allorché verranno definite ALLORITMICHE.
I BEV possono presentarsi in forma BIGEMINA se all'elettrocardiogramma compaiono tra due battiti sinusali, in forma TRIGEMINA tra tre battiti sinusali e così via.
Le extrasistole ventricolari possono presentarsi anche in COPPIA ovvero due extrasistole vicine in TRIPLETTA o tre extrasistole ravvicinate, QUADRUPLE quattro extra ravvicinate, mentre se si presentano da cinque in su vengono definite SALVE VENTRICOLARE.
Le extrasistole ventricolari possono essere di due morfologie ovvero MONOMORFE ad una morfologia oppure POLIMORFE a più morfologie.
Le extrasistole ventricolari molto spesso non nascendo nel normale sistema di conduzione ma bensì nella parete libera del ventricolo in questione all'ecg si presentano con un complesso ventricolare QRS largo maggiore di 0,12 msec ma capita che a volte essi si presentino con un QRS STRETTO nel momento in cui il battito prematuro insorga all'interno del sistema di conduzione.
Con l'asse elettrico del QRS del battito ectopico ventricolare e' possibile stabilire l' esatta sede d'insorgenza dell'extrasistola infatti con un asse rivolto verso l'alto si presuppone l' insorgenza verso l'apice cardiaco mentre con l'asse rivolto verso il basso si presuppone l' insorgenza verso il TRATTO DI EFFLUSSO.
Dalla morfologia dell'extrasistola e' possibile stabilire se il ventricolo coinvolto e' quello destro oppure il sinistro infatti se un battito ectopico ventricolare si presenta a tipi di blocco di branca sinistra la sua origine sarà dal ventricoli destro mentre se e' a tipo di blocco di branca destra l' origine sarà dal ventricolo sinistro.
Diverse sono le cause che portano alla formazione delle extrasistole, le più accreditate sono: l' AUTOMATISMO ANORMALE ovvero la formazione dell'impulso anomalo, il RIENTRO ovvero la formazione di un circuito di rientro che fa muovere un impulso su se stesso e l' ATTIVITÀ TRIGGERATA ovvero un impulso scatenante.
Nel normale automatismo le cellule atte alla formazione e alla conduzione dell'impulso elettrico si trovano nel NODO SENO ATRIALE NEL NODO ATRIO VENTRICOLARE NEL FASCIO DI HIS CON LE SUE DIRAMAZIONI E NELLE FIBRE DEL PURKINJE.
La maggior parte di queste cellule possiede una bassa frequenza di scarica e intervengono solo nel momento in cui il pacemaker fisiologico ovvero il nodo seno atriale ha una frequenza molto bassa o il suo impulso non riesce ad arrivare ai ventricoli.
Nell'AUTOMATISMO ANORMALE invece queste cellule preposte si trovano nel miocardio comune sia atriale che ventricolare.
Nel normale automatismo la normale attivazione dell'impulso e' a carico degli IONI SODIO mentre in quello ANORMALE a carico degli IONI CALCIO.
Per quanto riguarda il RIENTRO, le extrasistole ventricolari possono essere innescate da dei microrientri che possono formarsi vicino alle diramazioni della rete del Purkinje oppure in un tessuto fibroso al cui interno ci sia la presenza di aree vitali.
Esistono delle oscillazioni del potenziale di membrana che si verificano durante o subito dopo il potenziale d'azione che possono essere responsabili di battiti ectopici ventricolari in tal caso si usa il termine di ATTIVITA' TRIGGERATA.
i POSTPOTENZIALI dipendono dal battito precedente e le aitmie legate a questo meccanismo hanno sempre una causa scatenante. Esistono due tipi di POSTPOTENZIALI divisi in PRECOCI E TARDIVI, le aritmie che insorgono per POSTPOTENZIALI TARDIVI sono quveelle da INTOSSICAZIONE DIGITALICA, IPOKALIEMIA, IPOCALCEMIA E IPOMAGNESIEMIA o ingestione di alte dosi di CAFFEINA.
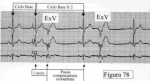
La diagnosi elettrocardiografica delle extrasistole ventricolari si basa sull'individuazione di battiti prematuri con un coplesso QRS largo, tuttavia va escluso che un battito largo sia dovuto ad un'extrasistola sopraventricolare condotta con aberranza a causa di un blocco di branca destra quindi occorre analizzare attentamente 'attivazione dell'onda P ( se visibile ) il rapporto tra onda P e complesso QRS e la morfologia del QRS ma uno degli elementi che chiarisce maggiormente se si tratta di un BATTITO ECTOPICO VENTRICOLARE O DI UN BATTITO ECTOPICO SOPRAVENTRICOLARE è la PAUSA che ne consegue, che sarà COMPENSATORIA PER LE EXTRASISTOLE VENTRICOLARI E non compensatoria per LE EXTRASISTOLE SOPRAVENTRICOLARI.
LE EXTRASISTOLE SOPRAVENTRICOLARI
Le extrasistole sopraventricolari riconosciute anche come battiti ectopici sopraventricolari o BESV, sono degli impulsi prematuri o anticipati che nascono in zone diverse negli atri o nella giunzione atrioventricolare. Possono presentarsi in forma sporadica o ripetitiva solo in rari casi viene previsto l'utilizzo di beta bloccanti ma possono comunque innescare aritmie sopraventricolari come la fibrillazione atriale.
Le extrasistole sopraventricolari possono insorgere per un'attività triggerata, per un esaltato automatismo o più semplicemente per un circuito di rientro.
Esse rappresentano un'attivazione atriale anticipata che può insorgere come un accoppiamento ( la classica sensazione di doppio battito ) oppure con un intervallo post extrasistolico la cui pausa non è compensatoria.
Essendo un battito diverso da quello sinusale, l'onda P che ne consegue, sarà diversa sia come morfologia che come asse dalla P sinusale e talvolta è possibile identificare, tramite un'attenta analisi del tracciato elettrocardiografico, la sede esattada cui proviene l'extrasistola.
A volte può risultare difficoltosa l'individuazione dell'extrasistola poichè essa può coincidere con l'onda T del battito precedente.
La conduzione dei battiti ectopici sopraventricolari ai ventricoli può essere normale, aberrante a causa di un rallentamento di conduzione intraventricolare oppure bloccata con la conseguente pausa.
Le extrasistole sopraventricolari possono presentarsi in soggetti con cuore sano ma anche in caso di processi infiammatori, ischemici o più semplicemente per abuso di sostanze stimolanti come alcol tabacco e caffeina.
Studi condotti a metà degli anni 90 in Francia da Haiissaguerre hanno permesso di identificare come alcuni focus ectopici ovvero siti sensibili di innesciìo di extrasistole sopraventricolari come ad esempio l'ostio delle vene polmonari fossero in grado di innescare e mantenere non solo la fibrillazione atriale ma anche il flutter e altre aritmie in cui è previsto un circuito di rientro.
La comparsa di BESV subito dopo la cardioversione elettrica può suffragare una recidiva di aritmia a breve.
Recentemente è stato dimostrato che un numero maggiore di 32 BESV all'ora è fortemente predittorio di recidive di fibrillazione atriale ad un mese.
Nel sesso femminile la sede di origine delle extrasistole sopraventricolari in grado di innescare fibrillazione atriale è la vena cava superiore probabilmente per un'esaltata attività parasimpatica ma altre sedi possono essere il legamento di Marshall, la parete posteriore dell'atrio sinistro o l'ostio del seno coronarico.
La possibilità di identificare la sede esatta dei battiti ectopici può essere un valido aiuto alla terapia ablativa della fibrillazione atriale, se si è certi che tale aritmia sia causata da esse.

TACHICARDIA DA RIENTRO NEL NODO ATRIO VENTRICOLARE (TRNAV): UNA QUESTIONE DI CORSIE PREFERENZIALI
COME NASCE UN BATTITO CARDIACO
Dobbiamo immaginare la cellula cardiaca come qualsiasi altra cellula del nostro corpo. La vita non potrebbe aver inizio se ognuna di queste cellule non fosse dotata esternamente di una membrana semi permeabile in grado cioè di far penetrare nel suo interno alcune sostanze e altre no.
ANATOMIA DEL SISTEMA DI CONDUZIONE
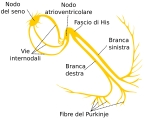
Nonostante che il cuore venga definito nlla sua interezza come un sistema di conduzione, in realtà solo alcune delle sue parti svolgono questa funzione e sono il NODO SENO ATRIALE LE VIE INTERNODALI, IL NODO ATRIO VENTRICOLARE IL FASCIO DI HIS E LE SUE BRANCHE ED INFINE LA RETE DEL PURKNJE
Il NODO DEL SENO o NODO SENO ATRIALE definito anche come PACEMAKER FISIOLOGICOO in età adulta può raggiungere gli 1 e 2 cm di lunghezza per 0,5 cm di larghezza, è situato in atrio destro subito sotto la zona epicardica o subepicardica vicino al solco terminale in una zona compresa tra la vena cava superiore e l'auricola destra.
Il nodo del seno riceve il sangue da un'arteria che prende il suo stesso nome e che origina nel 55% dei casi dall'arteria coronaria destra e per il restante 45% dei casi dall'arteria coronaria sinistra, penetra al centro del nodo per irrorare sangue nella cresta terminale e nella maggior parte dell'atrio destro.
Le VIE INTERNODALI sono fasci di fibre nervose che collegano il NODO SENO ATIALE al NODO ATRIO VENTRICOLARE, vengono differenziate oltre che per il nome anche per la loro posizione in SUPERFICIALE O ANTERORE, INTERMEDIA E INFINE PROFONDA O INFERIORE.
IL FASCIO DI JAMES è il fascio che origina nella parte superficiale del NODO SENO ATRIALE detta TESTA, percorre la parte superiore del SETTO INTERATRIALE ovvero il setto tra i due atri e si attacca alla parte superiore del NODO ATRIO VENTRICOLARE, da questo punto superiore si origina un altro fascio denominato FASCIO DI BACHMANN che ha il compito di condurre l'impulso elettrico all'atrio SINISTRO.
Il fascio di WENCKEBACH ha origine nella parte INTERMEDIA del NODO SENO ATRIALE conflisce nel lembo della FOSSA OVALE nel setto per congiungersi anch'esso con la parte superiore del NODO ATRIO VENTRICOLARE.
IL FASCIO DI THOREL infine origina nella porzione inferiore del NODO SENO ATRIALE detta CODA decorre nella zona inferiore del SETTO raggiunge il SENO CORONARICO e si attacca alla parte inferiore del NODO ATRIO VENTRICOLARE.
Dopo che si sno ricongiunte nel NODO ATRIO VENTRICOLARE i fasci di fibre perdono la loro identità in una zona denominata GIUNZIONE ATRIO VENTRICOLARE DI TAWARA comprendente anche il NODO ATRIO VENTRICOLARE IL FASCIO DI HIS E LE BRANCHE.
Il NODO ATRIO VENTRICOLARE O NODO AV è una struttura a forma di uovo o ovoidale in età adulta raggiunge una dimensione tra i 5 e i 7 mm di lunghezza e tra i 3 e i 5 mm di spessore, è situato tra il seno coronarico e una parte della valvola tricuspide. Questa area è assai importante e viene denominata come TRIANGOLO DI KOCH è delimitata posteriormente dal SENO CORONARICO, inferiormente dalla VALVOLA TRICUSPIDE e in alto dal tendine del TODARO.
Il NODO ATRIO VENTRICOLARE per le sue caratteristiche morfologiche e di conduzione dell'impulso è suddiviso in tre aree ben distinte una zona ATRIO NODALE, una zona di NODO COMPATTO e una zona NODO HISIANA.
Il NODO ATRIO VENTRICOLARE è vascolarizzato prevalentemente da un ramo settale che origina dall'ARTERIA CORONARIA DISCENDENTE ANTERIORE.
Dalla sezione inferiore del NODO ATRIO VENTRICOLARE origina il FASCIO DI HIS un piccolo fascio di fibre nervose lungo circa 1,5-2 mm il quale successivamente si divide in due BRANCHE DESTRA E SINISTRA. La BRANCA SINISTRA si divide ulteriormente in altri due FASCI uno posteriore e uno anteriore. Il POSTERIORE, decorre lungo la zona POSTERIORE del SETTO INTERVENTRICOLARE mentre quello ANTERIORE percorre la zona SETTALE INTERVENTRICOLARE ma dlla parte ANTERO SUPERIORE per terminare in un muscolo denominato PAPILLARE.
Infine ìvi è la rete del PURKINJE ovvero un agglomerato di cellule fitte che formano una rete molto simili alle caratteristiche delle cellule del miocardio
ANATOMIA DEL SISTEMA DI CONDUZIONE
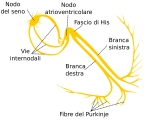
Nonostante che il cuore venga definito nlla sua interezza come un sistema di conduzione, in realtà solo alcune delle sue parti svolgono questa funzione e sono il NODO SENO ATRIALE LE VIE INTERNODALI, IL NODO ATRIO VENTRICOLARE IL FASCIO DI HIS E LE SUE BRANCHE ED INFINE LA RETE DEL PURKNJE
Il NODO DEL SENO o NODO SENO ATRIALE definito anche come PACEMAKER FISIOLOGICOO in età adulta può raggiungere gli 1 e 2 cm di lunghezza per 0,5 cm di larghezza, è situato in atrio destro subito sotto la zona epicardica o subepicardica vicino al solco terminale in una zona compresa tra la vena cava superiore e l'auricola destra.
Il nodo del seno riceve il sangue da un'arteria che prende il suo stesso nome e che origina nel 55% dei casi dall'arteria coronaria destra e per il restante 45% dei casi dall'arteria coronaria sinistra, penetra al centro del nodo per irrorare sangue nella cresta terminale e nella maggior parte dell'atrio destro.
Le VIE INTERNODALI sono fasci di fibre nervose che collegano il NODO SENO ATIALE al NODO ATRIO VENTRICOLARE, vengono differenziate oltre che per il nome anche per la loro posizione in SUPERFICIALE O ANTERORE, INTERMEDIA E INFINE PROFONDA O INFERIORE.
IL FASCIO DI JAMES è il fascio che origina nella parte superficiale del NODO SENO ATRIALE detta TESTA, percorre la parte superiore del SETTO INTERATRIALE ovvero il setto tra i due atri e si attacca alla parte superiore del NODO ATRIO VENTRICOLARE, da questo punto superiore si origina un altro fascio denominato FASCIO DI BACHMANN che ha il compito di condurre l'impulso elettrico all'atrio SINISTRO.
Il fascio di WENCKEBACH ha origine nella parte INTERMEDIA del NODO SENO ATRIALE conflisce nel lembo della FOSSA OVALE nel setto per congiungersi anch'esso con la parte superiore del NODO ATRIO VENTRICOLARE.
IL FASCIO DI THOREL infine origina nella porzione inferiore del NODO SENO ATRIALE detta CODA decorre nella zona inferiore del SETTO raggiunge il SENO CORONARICO e si attacca alla parte inferiore del NODO ATRIO VENTRICOLARE.
Dopo che si sno ricongiunte nel NODO ATRIO VENTRICOLARE i fasci di fibre perdono la loro identità in una zona denominata GIUNZIONE ATRIO VENTRICOLARE DI TAWARA comprendente anche il NODO ATRIO VENTRICOLARE IL FASCIO DI HIS E LE BRANCHE.
Il NODO ATRIO VENTRICOLARE O NODO AV è una struttura a forma di uovo o ovoidale in età adulta raggiunge una dimensione tra i 5 e i 7 mm di lunghezza e tra i 3 e i 5 mm di spessore, è situato tra il seno coronarico e una parte della valvola tricuspide. Questa area è assai importante e viene denominata come TRIANGOLO DI KOCH è delimitata posteriormente dal SENO CORONARICO, inferiormente dalla VALVOLA TRICUSPIDE e in alto dal tendine del TODARO.
Il NODO ATRIO VENTRICOLARE per le sue caratteristiche morfologiche e di conduzione dell'impulso è suddiviso in tre aree ben distinte una zona ATRIO NODALE, una zona di NODO COMPATTO e una zona NODO HISIANA.
Il NODO ATRIO VENTRICOLARE è vascolarizzato prevalentemente da un ramo settale che origina dall'ARTERIA CORONARIA DISCENDENTE ANTERIORE.
Dalla sezione inferiore del NODO ATRIO VENTRICOLARE origina il FASCIO DI HIS un piccolo fascio di fibre nervose lungo circa 1,5-2 mm il quale successivamente si divide in due BRANCHE DESTRA E SINISTRA. La BRANCA SINISTRA si divide ulteriormente in altri due FASCI uno posteriore e uno anteriore. Il POSTERIORE, decorre lungo la zona POSTERIORE del SETTO INTERVENTRICOLARE mentre quello ANTERIORE percorre la zona SETTALE INTERVENTRICOLARE ma dlla parte ANTERO SUPERIORE per terminare in un muscolo denominato PAPILLARE.
Infine ìvi è la rete del PURKINJE ovvero un agglomerato di cellule fitte che formano una rete molto simili alle caratteristiche delle cellule del miocardio